Le cannabis synthétique modifie le cerveau adolescent

Biological Psychiatry / Reelin Deficiency and Synaptic Impairment in Adolescent PFC following Initial Synthetic Cannabinoid Exposure
Même une consommation unique de substances comme le cannabis ou les cannabinoïdes de synthèse peut laisser des traces durables dans le cerveau. Cet effet est particulièrement marqué chez les adolescents, dont le cerveau est en pleine croissance.
Le cortex préfrontal, la région cérébrale associée à la prise de décision, au contrôle des impulsions et aux interactions sociales, est particulièrement vulnérable pendant cette période. L’exposition aux cannabinoïdes de synthèse peut perturber son développement normal, entraînant à long terme des difficultés cognitives et comportementales.
Une protéine essentielle au développement et au fonctionnement du cerveau, la Reelin, est affectée par la consommation de ces substances. Une diminution des niveaux de Reelin peut altérer la communication entre les neurones, déséquilibrer les signaux cérébraux et réduire la plasticité cérébrale. Ces perturbations contribuent aux problèmes comportementaux observés chez les consommateurs de cannabinoïdes de synthèse.
Des recherches menées sur des souris mâles adolescentes ont montré qu’une seule dose de cannabinoïde de synthèse peut fortement réduire les niveaux de Reelin dans certaines régions du cortex préfrontal. Cette diminution n’est pas due à une production moindre de la protéine, mais plutôt à une dégradation accélérée.
Il est intéressant de noter que les récepteurs cannabinoïdes CB1R et la Reelin sont souvent associés dans les mêmes cellules cérébrales. Les chercheurs ont confirmé que la réduction de la Reelin, provoquée par les cannabinoïdes de synthèse, est liée à l’activation de ces récepteurs.
Translational Psychiatry 2025
L’exposition prénatale au cannabidiol modifie différemment, selon le sexe, le développement des comportements liés à l’anxiété
De nombreuses femmes enceintes utilisent le cannabidiol (CBD) comme remède naturel pour soulager des symptômes tels que les nausées, l’insomnie, l’anxiété ou les douleurs chroniques. Jusqu’à 20 % des grossesses aux États‑Unis et au Canada pourraient impliquer l’usage de produits contenant uniquement du CBD. Le CBD traverse le placenta et peut affecter le développement fœtal, avec un risque potentiel de troubles neuropsychiatriques ultérieurs. Étant donné la compréhension encore limitée des effets du CBD pendant la grossesse, nous avons adopté une approche longitudinale afin d’étudier la trajectoire neurodéveloppementale associée à une exposition prénatale au CBD.
Des souris gestantes ont reçu 3 mg/kg de CBD entre les jours 5 et 18 de gestation. À l’adolescence précoce, la descendance présentait des modifications comportementales spécifiques au sexe. Les femelles, mais non les mâles, manifestaient un phénotype anxieux complexe lors du test du labyrinthe en croix surélevé. Ce phénotype persistait à l’âge adulte dans le test de champ ouvert et s’accompagnait d’une altération de la réactivité à la récompense. Tout au long de la vie postnatale, les femelles exposées montraient une augmentation des postures d’étirement‑surveillance, un comportement d’évaluation du risque reflétant des tendances d’approche‑évitation et une anxiété accrue. Enfin, l’exposition prénatale au CBD augmentait les comportements répétitifs chez les animaux adultes des deux sexes, comme le démontrait le test d’enfouissement de billes.
Ces résultats apportent des preuves solides de perturbations spécifiques au sexe dans les trajectoires développementales des comportements anxieux associées à l’exposition prénatale au CBD. Ils remettent en question la perception selon laquelle le CBD serait universellement sûr et mettent en lumière des vulnérabilités liées à son usage pendant la gestation.
BioRxiv 2025

Cannabinoïdes prénataux : modifications spécifiques au sexe dans l’évaluation du risque et augmentation partagée des comportements répétitifs chez la descendance adulte.
La perception répandue des cannabinoïdes comme remèdes inoffensifs a entraîné une augmentation de l’usage du cannabidiol (CBD) et du Δ9‑tétrahydrocannabinol (THC) pendant la grossesse, bien que leurs effets à long terme sur la descendance restent mal caractérisés. Dans cette étude, des souris gestantes ont reçu quotidiennement du CBD ou du THC (3 mg/kg, jours gestationnels 5–18), et leurs descendants adultes (P90–120) ont été évalués pour des comportements émotionnels et défensifs. L’exposition prénatale au CBD a augmenté les postures d’évaluation du risque chez les femelles, indiquant une vigilance accrue, tandis qu’aucun effet n’a été observé chez les mâles. Le THC n’a pas modifié l’évaluation du risque mais a induit une hyperlocomotion chez les femelles. Les indices classiques d’anxiété, tels que le temps passé dans les bras ouverts ou fermés, la préférence pour les bras ouverts et la distance parcourue, sont restés inchangés. En revanche, le test d’enfouissement de billes a révélé une augmentation des comportements répétitifs et défensifs chez les mâles comme chez les femelles exposés au CBD ou au THC. Ces résultats montrent que l’exposition prénatale aux cannabinoïdes entraîne des altérations comportementales durables et dépendantes du sexe, le CBD accroissant sélectivement l’évaluation du risque chez les femelles et les deux cannabinoïdes augmentant les comportements répétitifs dans les deux sexes, ce qui remet en cause l’idée que le CBD constitue une alternative bénigne au THC pendant la gestation.
Potentiel thérapeutique et polypharmacologie du cannabidiol dans les troubles neuropsychiatriques
Trends in Pharmacological Sciences
Le cannabidiol (CBD), principal composé non intoxicant du cannabis, est actuellement approuvé pour traiter certaines formes rares et résistantes d’épilepsie. Des recherches précliniques récentes mettent en évidence les mécanismes d’action complexes du CBD dans le cerveau, impliquant plusieurs cibles moléculaires, ce qui expliquerait ses propriétés neuroprotectrices, anti-inflammatoires, anxiolytiques et antipsychotiques. Par ailleurs, des essais cliniques explorent son potentiel thérapeutique au-delà de ces indications actuelles.
Cette revue met l’accent sur la polypharmacologie du CBD et analyse les données précliniques et cliniques les plus récentes concernant son efficacité dans les troubles neuropsychiatriques.
Les recherches actuelles suggèrent que la capacité du CBD à moduler différentes voies de signalisation pourrait offrir des bénéfices pour ces troubles. Nous proposons des axes de recherche supplémentaires pour mieux comprendre ses mécanismes d’action, combler les lacunes dans les connaissances et préciser ses applications thérapeutiques.
Le CBD pendant la grossesse façonne le cortex insulaire à l'âge adulte

Cells
De nombreuses futures mamans utilisent le CBD pour soulager des symptômes comme les nausées, l’insomnie, l’anxiété et la douleur, malgré le peu de recherches sur ses effets à long terme. Cependant, le CBD traverse le placenta, ce qui peut affecter le développement du fœtus et influencer le comportement des enfants. Nous avons étudié comment l’exposition prénatale au CBD affecte le cortex insulaire (CI), une zone du cerveau impliquée dans le traitement des émotions et liée à des troubles psychiatriques.
Le CI se divise en deux parties : le CI antérieur (CIA), qui traite les signaux socio-émotionnels, et le CI postérieur (CIP), spécialisé dans la perception interne et la douleur. Les neurones pyramidaux dans le CIA et le CIP montrent des caractéristiques électrophysiologiques qui varient selon le sexe, notamment en ce qui concerne l’excitabilité et l’équilibre entre les signaux excitants et inhibiteurs.
Nous avons examiné les propriétés cellulaires du CI et la force des connexions synaptiques chez les descendants des deux sexes issus de souris exposées à de faibles doses de CBD pendant la gestation (E5–E18 ; 3 mg/kg, s.c.). L’exposition prénatale au CBD a entraîné des changements spécifiques au sexe et à la région dans les propriétés de la membrane et l’excitabilité, ainsi que dans l’équilibre excitation/inhibition, chez les descendants adultes. Les résultats montrent que l’exposition au CBD in utero perturbe le développement neuronal du CI, ce qui entraîne une perte de distinction fonctionnelle entre les différentes régions du CI. Ces découvertes pourraient avoir des implications importantes pour comprendre comment le CBD affecte les comportements émotionnels chez les enfants.
Comportement adaptatif des souris X fragiles dans un environnement inconnu

Gabriele Giua, Benjamin Strauss, Olivier Lassalle, Pascale Chavis, Olivier J. Manzoni
Le syndrome de l’X fragile (SXF) représente une cause majeure de déficience intellectuelle d’origine génétique et est étroitement associé à l’autisme. Les caractéristiques du SXF incluent des altérations significatives du comportement social, telles que le retrait social, l’évitement du contact visuel, une augmentation de l’anxiété sociale, des niveaux d’excitation élevés, des difficultés langagières et des défis dans la régulation émotionnelle. Les évaluations comportementales traditionnelles se concentrent généralement sur des interactions à court terme en environnements contrôlés. Dans cette étude, nous avons mené une évaluation complète du comportement adaptatif en groupe des souris atteintes du SXF sur une période de trois jours, sans introduire d’interventions expérimentales ni d’évaluations basées sur des tâches. Les résultats ont mis en lumière des altérations comportementales complexes, avec les changements les plus significatifs se produisant lors de l’adaptation initiale à des environnements non familiers. Certains comportements ont progressivement retrouvé des schémas plus typiques au fil du temps. Ce phénotype dynamique du SXF s’est caractérisé par une activité accrue, marquée par une exploration plus poussée, un intérêt social amplifié, et une approche inhabituelle des interactions sociales, incluant une fréquence plus élevée d’engagements de courte durée. Ces découvertes contribuent à une meilleure compréhension du comportement social chez les individus atteints du SXF, mettant en évidence l’importance de comprendre leurs réponses adaptatives dans divers contextes environnementaux.
Nos recherches dans l'actualité de la FENS et d'ailleurs

Effets à long terme du Cannabidiol CBD in-utero
https://medicalxpress.com/news/2024-06-safety-cannabidiol-pregnant-women.html
Disruptions spécifiques aux cellules et aux voies dans l'accumbens de la souris Fragile X

Gabriele Giua, Jessica Pereira-Silva, Alba Caceres-Rodriguez, Olivier Lassalle, Pascale Chavis, Olivier J. Manzoni
Le syndrome de l’X fragile (FXS) est une cause génétique de déficience intellectuelle et de troubles du spectre autistique (TSA), souvent associé à des difficultés sociales. Une partie clé du cerveau, appelée système mésocorticolimbique, qui comprend le cortex préfrontal (PFC), l’amygdale basolatérale (BLA) et le noyau accumbens (NAc), joue un rôle crucial dans la régulation des comportements socio-émotionnels.
Dans cette étude, nous avons utilisé une technique avancée, l’optogénétique, pour comparer les propriétés fonctionnelles des voies neuronales BLA→NAc, PFC→NAc, et la voie réciproque PFC↔BLA chez des souris modèles du FXS. Nous avons découvert que la voie réciproque PFC↔BLA restait intacte chez ces souris, tandis que des modifications synaptiques significatives étaient observées dans les voies BLA/PFC→NAc.
Plus précisément, nous avons constaté des changements distincts dans deux types de neurones du striatum (SPNs) : les neurones D1 et D2. Chez les souris FXS, la voie BLA→NAc vers les neurones D2 présentait une augmentation de la force synaptique, due à une augmentation des courants AMPAR et NMDAR, ainsi qu’une densité accrue des épines dendritiques, spécifiquement dans les neurones D2. En revanche, bien que la probabilité de déclenchement des neurones D1 ait été amplifiée dans la voie BLA→NAc, cela n’était pas accompagné d’une augmentation de la force synaptique ou de la densité des épines.
Ces altérations spécifiques aux voies ont conduit à une amélioration globale de l’efficacité avec laquelle les entrées excitatrices provoquent le déclenchement des neurones dans les voies BLA→NAc-D1 et BLA→NAc-D2. Enfin, l’absence de la protéine FMRP a entraîné une déficience de la dépression à long terme spécifiquement dans les neurones D1 de la voie BLA→NAc.
Cette recherche met en lumière la vulnérabilité accrue du noyau accumbens en raison de la déficience en FMRP, soulignant son rôle central dans la pathophysiologie du syndrome de l’X fragile.

Différences entre les sexes dans les propriétés neuronales et synaptiques des sous-régions du cortex insulaire de la souris
Ecoutez le résumé: ScienceCast ici
Le cortex insulaire (IC) joue un rôle central dans le traitement des informations interoceptives et émotionnelles. Le CI comprend deux sous-régions distinctes : le cortex insulaire antérieur (aIC), qui traite les signaux émotionnels et sociaux, et le cortex insulaire postérieur (pIC), spécialisé dans l’interception et la perception de la douleur. Les neurones pyramidaux de projection au sein du CI intègrent des entrées sensorielles multimodales, influençant le comportement et la cognition. Malgré les recherches antérieures axées sur la connectivité neuronale et la transcriptomique, il existe un manque de compréhension des caractéristiques des neurones pyramidaux entre les sous-régions et entre les sexes.
Des différences claires sont apparues entre les neurones aIC et pIC chez les mâles et les femelles : les neurones aIC présentaient des caractéristiques distinctives telles qu’une taille plus grande, une hyperpolarisation accrue et un seuil de rhéobase plus élevé par rapport à leurs homologues pIC. De plus, nous avons observé des variations dans l’excitabilité neuronale liées au sexe, les neurones pIC mâles présentant un niveau d’excitabilité plus élevé que leurs homologues femelles. Nous avons également identifié des différences spécifiques à la région dans l’activité synaptique excitatrice et inhibitrice et l’équilibre entre excitation et inhibition chez les souris mâles et femelles. Les femelles adultes ont démontré une force synaptique supérieure et une réponse maximale dans le aIC par rapport au pIC. Enfin, une potentialisation synaptique à long terme s’est produite dans les deux sous-régions chez les mâles, mais était spécifique au aIC chez les femelles.
En conclusion, il existe des différences sexuelles dans la plasticité synaptique et la transmission excitatrice dans les sous-régions du CI, et que les propriétés distinctes des neurones pyramidaux du CI entre les sexes pourraient contribuer aux différences de comportement et de cognition entre les hommes et les femmes.
Sexe et génétique: Modulation de la vocalisation et de la cognition dépendante du sexe et du dosage génique de Fmr1 dans un modèle murin du syndrome de l'X fragile

Gabriele Giua, Daniela Iezzi, Alba Caceres-Rodriguez, Benjamin Strauss, Pascale Chavis, Olivier J. Manzoni
Les vocalisations ultrasoniques (USV) des souriceaux envers leur mère sont essentielles au développement cognitif et socio-émotionnel. Dans l’autisme et le syndrome de l’X fragile (FXS), les perturbations de la communication USV entre les souriceaux et leur mère suggèrent un lien possible entre les anormalités de la communication USV durant le développement précoce et l’apparition ultérieure de déficits de communication et sociaux.
Méthodes: Nous avons enregistré les USV chez des souriceaux atteints du syndrome de l’X fragile à PND 10 (10 jours après la naissance) pendant une courte période de séparation d’avec leur mère. Cela incluait des animaux de tous les génotypes possibles et des deux sexes (c’est-à-dire des mâles Fmr1-/y et Fmr1+/y, ainsi que des femelles Fmr1+/+, +/- et -/-). Cela nous a permis de comparer l’influence du sexe et du dosage génétique sur les capacités de communication des souriceaux. En analysant les motifs vocaux, nous avons examiné les comportements vocaux complexes tels que la structure des appels, leur durée, leur modulation fréquentielle et leurs schémas temporels. De plus, le comportement de retour vers le nid a été évalué comme un indicateur sensible du développement cognitif précoce et de la discrimination sociale. Ce comportement repose sur l’utilisation de signaux olfactifs et thermiques pour se déplacer et rechercher l’odeur maternelle ou du nid dans l’environnement.
Résultats: Les résultats montrent que les souriceaux déficients en FMRP, des deux sexes, ont une plus grande propension à vocaliser lorsqu’ils sont séparés de leur mère, et ce comportement s’accompagne de changements significatifs spécifiques au sexe dans les principales caractéristiques de leurs USV, ainsi que dans leur poids corporel. L’analyse du répertoire vocal et de l’utilisation syntaxique a révélé que l’inactivation du gène Fmr1 modifie principalement la composition qualitative des USV chez les mâles. De plus, des effets spécifiques au sexe de l’inactivation de Fmr1 sur l’activité locomotrice et le comportement de retour vers le nid ont été observés. La déficience en FMRP chez les femelles augmente l’activité, réduit le temps nécessaire pour atteindre le nid et prolonge le temps passé au nid. Chez les mâles, elle prolonge le temps nécessaire pour atteindre le nid et réduit le temps passé au nid sans affecter la locomotion.
Ces résultats mettent en évidence l’interaction entre le dosage génétique de Fmr1 et le sexe dans l’influence des compétences communicatives et cognitives pendant la petite enfance.

Le déficit de dépression à long terme et les altérations sociales induites par la cocaïne sont restaurés par l'inhibition de la FAAH.
Background
A single usage of a drug of abuse can have lasting effects on both the brain and behavior, continuing even after the drug has been metabolized and eliminated from the body. A single dose of cocaine can abolish endocannabinoid-mediated long-term depression (eCB-LTD) in the nucleus accumbens (NAc) within 24 hours of administration. However, it is uncertain whether this altered neuroplasticity entails a behavioral deficit.
Methods
Our study employed adult male mice to investigate the effects of a single dose of cocaine (20 mg/kg) on eCB-LTD, saccharin preference, and social interactions 24 hours after administration. We also examined the gene expression in components of the eCB system. The pharmacological increase of anandamide was evaluated using the fatty acid amide hydrolase (FAAH) inhibitor URB597 (1 mg/kg).
Results
After a single dose of cocaine, mice displayed altered plasticity, social interactions, and preference for saccharin and a reduction in mRNA levels of the anandamide-catabolizing enzyme NAPE-PLD. We discovered that the FAAH inhibitor URB597 (1 mg/kg) successfully reversed the cocaine-induced loss of eCB-LTD in the NAc and restored normal social interaction in cocaine-exposed mice, but it did not affect their saccharin preference.
Conclusions
Overall, this research underlines the neuroplastic changes and subsequent behavioral alterations that occur after the initial use of cocaine, while also suggesting a potential role for anandamide in the early impairments caused by cocaine. The findings highlight the importance of understanding the mechanisms underlying the initiation of drug use and offer a potential therapeutic target.

Custom made python LMT scripts de l'équipe Chavis-Manzoni
https://gitlab.com/chavis_manzoni_lab/lmt-scripts
tout les scripts par Benjamin Strauss
Effets cellulaires spécifiques de la déficience en FMRP sur les neurones épineux de l'accumbens
G. Giua, O. Lassalle, L. Makrini-Maleville, E. Valjent, P. Chavis and O. Manzoni
Fragile X syndrome (FXS) is a common genetic cause of autism and inherited intellectual disability. This condition arises from a mutation in the Fmr1 gene, which produces Fragile X Messenger Ribonucleoprotein (FMRP). Patients with FXS display cognitive, emotional, and social impairments, often associated with dysfunction in the nucleus accumbens (NAc), a region of the brain that regulates social behavior. The primary cell type in the NAc, spiny projection neurons (SPNs), exist in two subtypes, differentiated by the expression of either dopamine D1 or D2 receptors, their connectivity, and related behavioral functions.
We generated a novel mouse model (Fmr1y/0: Drd1a-tdTomato) to examine how the absence of FMRP affects these SPN subtypes. We found Fmr1 transcripts and FMRP in both SPN subtypes, suggesting Fmr1’s functions may vary cell by cell. In mice with the Fmr1 mutation, the membrane properties and action potential kinetics which normally differ between D1- and D2-SPNs were either reversed or disappeared altogether. The analysis revealed that the Fmr1 mutation significantly alters the phenotypic traits that distinguish each cell type in healthy mice.
Thus, the absence of FMRP in FXS mice disrupts the normal distinction between NAc D1- and D2-SPNs, resulting in a uniform cell phenotype. This uniformity might contribute to selected aspects of the disorder’s pathology.
Trajectoire maturationnelle spécifique au sexe de la plasticité endocannabinoïde dans le cortex préfrontal du rat.

Axel Bernabeu, Anissa Bara, Antonia Manduca, Milene Borsoi, Olivier Lassalle, Anne-Laure Pelissier-Alicot, OJJ Manzoni
Cette étude identifie les différences de développement synaptique dans le cortex préfrontal entre les rats mâles et femelles. Nos résultats indiquent qu’il existe des différences spécifiques au sexe dans l’excitabilité des neurones pyramidaux de la couche 5 du PFC, les femelles adultes présentant une excitabilité plus faible qu’aux autres stades de développement. De plus, nous avons observé un développement sexuellement dimorphiques de la dépression à long terme médiée par l’endocannabinoïde, suggérant que les hormones sexuelles jouent un rôle dans la plasticité synaptique pendant l’adolescence.
L’engagement des récepteurs endovanilloïdes TRPV1R ou CB1R pendant la LTD était séquentiel et sexuellement dimorphique, ce qui indique que les mécanismes sous-jacents de la LTD diffèrent entre les rats mâles et femelles. De plus, l’expression génique des systèmes eCB/endovanilloïde était également séquentielle et spécifique au sexe, les femelles présentant un schéma d’expression génique différent de celui des mâles. Ces résultats soulignent l’importance de prendre en compte les différences de sexe dans le développement synaptique du cortex préfrontal et la nécessité de poursuivre les recherches dans ce domaine.
Notre étude a également identifié des cibles moléculaires spécifiques qui pourraient être utilisées pour améliorer la LTD chez les jeunes mâles, ce qui pourrait avoir des implications pour le traitement des troubles neuropsychiatriques associés à des déficits de plasticité synaptique dans le cortex préfrontal. Plus précisément, nos résultats suggèrent que l’inhibition de ABHD6 ou MAGL pourrait améliorer la LTD chez les jeunes mâles. Ces résultats pourraient avoir des implications importantes pour le développement de nouveaux traitements pharmacologiques pour des conditions telles que la schizophrénie, le trouble bipolaire et la dépression, qui ont été associées à une plasticité synaptique altérée dans le cortex préfrontal.
En résumé, notre étude fournit de nouvelles informations sur les mécanismes sous-jacents au développement synaptique du cortex préfrontal et souligne l’importance de prendre en compte les différences de sexe dans ce processus. Nos résultats identifient également des cibles moléculaires potentielles pour améliorer la LTD chez les jeunes mâles et fournissent une base pour de futures recherches dans ce domaine.
L'exposition in utero au cannabidiol (CBD) cause des altérations cognitives

Iezzi, Caceres-Rodriguez, Chavis & Manzoni
Le cannabidiol (CBD), l’un des principaux composants du cannabis, est généralement considéré comme sûr. Le CBD traverse le placenta et son utilisation pendant la grossesse est en constante augmentation, pourtant l’impact des effets du CBD gestationnel sur la vie prénatale et le neurodéveloppement sont peu connus.
Dans cette étude nous avons combiné des approches comportementales et une analyse d’apprentissage profond (Deep Learning) pour évaluer le comportement néonatal de la progéniture des deux sexes, exposée au CBD. Des mères en gestation ont été exposées quotidiennement à une faible dose de CBD (3 mg/Kg, s.c.), du jour 5 au jour 18 de la gestation. Le poids corporel, les vocalisations ultrasonores des souriceaux (USV) et le comportement de retour à la maison ont été quantifiés chez la progéniture. Ainsi, les souriceaux mâles (mais pas les femelles) issus de mères traitées au CBD ont pris plus de poids que les souriceaux témoins. Des différences dépendantes du sexe ont été observées dans les caractéristiques des vocalisations ultrasoniques. Les souriceaux mâles exposés au CBD en période prénatale émettaient des vocalisations plus courtes, tandis que les femelles exposées au CBD émettaient davantage de vocalisations à haute fréquence par rapport à leurs homologues témoins. Des changements qualitatifs significatifs ont été observés dans le répertoire syllabique des vocalisations ultrasoniques, reflétés dans les typologies d’appels et les modèles de communication. Enfin, le test de comportement de retour au foyer a montré que les femelles exposées à la CBD présentaient une plus grande vulnérabilité à l’exposition in utéro au CBD que les mâles. Les petites femelles exposées au CBD ont montré des capacités motrices et de discrimination cognitives réduites. L’ensemble des résultats suggère une divergence sexuelle dans les conséquences aux premiers âges du développement de l’exposition in utero au CBD. Compte tenu de l’ampleur de la consommation de cannabis et de CBD dans le monde, ces résultats remettent en question l’idée que le CBD est un composé universellement sûr et révèlent la nécessité d’études supplémentaires sur les effets de l’exposition périnatale au CBD.
Ces travaux ont été soutenu par l’Institut National de la Santé et de la Recherche Médicale (INSERM) le NIH (R01DA043982), l’IReSP et l’INCa dans le cadre d’un appel à candidatures pour des bourses doctorales lancé en 2022 (SPADOC22-003).
Le cannabis à l'adolescence : Altérations cognitives durables et mécanismes sous-jacents

Scheyer, Laviolette, Pelissier and Manzoni
La consommation de cannabis à l’adolescence est un domaine particulièrement préoccupant, en raison de l’évolution de la perception sociale et politique de cette drogue, et représente un défi scientifique, médical et économique. Des intérêts sociaux et économiques majeurs continuent de pousser à la légalisation du cannabis ainsi qu’au développement pharmaceutique. En conséquence, l’évolution des perceptions de la consommation légale et illicite de cannabis dans la population a modifié l’évaluation collective des dangers potentiels du produit. La vague de légalisation du cannabis s’accompagne donc d’une nouvelle responsabilité, celle d’éduquer le public sur les risques potentiels et les dangers connus associés au cannabis récréatif et médical. Parmi ceux-ci, on trouve le risque de conséquences cognitives et psychologiques à long terme, en particulier après une initiation précoce à la consommation, aggravée par un cannabis très puissant et/ou synthétique, et un usage intensif/fréquent de la drogue. Ces conséquences cognitives et psychiatriques sont sous-tendues par des aberrations durables dans le développement de la fonction synaptique, souvent secondaires à des changements épigénétiques. D’autres facteurs, tels que le risque génétique, les influences environnementales ou les agressions toxiques non médicamenteuses pendant le développement, contribuent également de manière importante à ces altérations fonctionnelles à long terme après la consommation de cannabis à l’adolescence. Des études précliniques indiquent que l’exposition aux cannabinoïdes pendant des périodes spécifiques de vulnérabilité (par exemple, l’adolescence) a un impact sur les processus neurodéveloppementaux et le comportement en modifiant durablement les circuits neuronaux, notamment la structure dendritique et les fonctions synaptiques, y compris celles normalement médiées par les cannabinoïdes endogènes.
Cannabis and the Developping Brain 1st Edition

Le Cannabis et le cerveau en développement 1ère édition
Cannabis and the Developing Brain présente les travaux récents sur les effets du cannabis au cours des étapes du neurodéveloppement (c’est-à-dire à l’âge périnatal et à l’adolescence). Le livre présente aux lecteurs les circuits neuronaux vivo et les mécanismes moléculaires et cellulaires affectés par l’exposition au cannabis pendant trois fenêtres temporelles différentes de vulnérabilité du cerveau. En outre, il offre un aperçu unique des caractéristiques neurobiologiques communes de l’exposition aux cannabinoïdes au cours des différentes périodes de développement. Enfin, l’ouvrage détermine l’impact négatif de l’exposition aux cannabinoïdes au cours du développement sur des cognitions, des émotions et des comportements spécifiques. La marijuana est le médicament psychotrope le plus utilisé aux États-Unis après l’alcool. Selon un rapport du NIH de 2018, plus de 11,8 millions de jeunes adultes ont déclaré avoir consommé de la marijuana. Avec la légalisation et la décriminalisation du cannabis, l’élan se poursuit et est propulsé par la réduction de la stigmatisation associée à sa consommation, d’où une préoccupation croissante concernant les impacts à long terme sur la fonction cérébrale et le comportement.
Trajectoires maturatives divergentes spécifiques au sexe dans l'amygdale basolatérale postnatale du rat
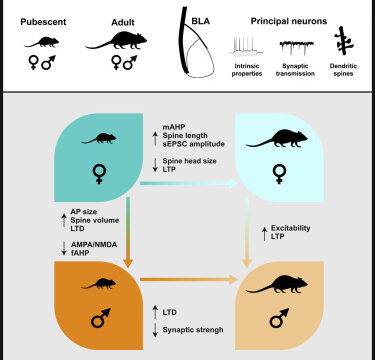
Guily, Lassalle, Chavis & Manzoni
L’amygdale basolatérale (BLA), la partie du complexe amygdalien impliquée dans la transduction des stimuli perceptifs en émotion, subit une profonde réorganisation à l’adolescence chez les rongeurs et les humains. La façon dont la plasticité cellulaire et synaptique évolue au cours du développement postnatal chez les deux sexes n’est que partiellement comprise. Nous avons utilisé une approche transversale pour comparer la morphologie, les propriétés neuronales et synaptiques des neurones de la BLA chez les rats des deux sexes à l’adolescence et à l’âge adulte. Alors que les neurones pyramidaux de la BLA de rats des deux sexes présentaient des relations courant-tension, des rhéobases et des potentiels de repos similaires pendant la puberté, des différences dans ces paramètres sont apparues entre les sexes à l’âge adulte : Les neurones de la BLA étaient plus excitables chez les mâles que chez les femelles. Pendant la pubescence, l’excitabilité des neurones de la BLA était plus élevée chez les femelles et inchangée chez les mâles. Les potentiels d’action des mâles étaient plus petits et plus courts que ceux des femelles et les post-hyperpolarisations rapides étaient plus importantes chez les mâles. Pendant la maturation post-natale, aucune différence dans la densité des épines n’a été observée entre les groupes ou les sexes, mais la longueur des épines a augmenté et diminué chez les femelles et les mâles, respectivement. Une réduction du diamètre et du volume de la tête des épines a été observée exclusivement chez les femelles. Les propriétés synaptiques de base ont également montré des différences de maturation spécifiques au sexe. Les relations stimulus-réponse et les amplitudes maximales du PEPSf étaient plus élevées chez les adolescents mâles que chez les adultes, mais étaient similaires chez les femmes des deux âges. Les courants postsynaptiques excitateurs spontanés médiés par les récepteurs AMPA étaient plus faibles dans les neurones de la BLA des adolescentes par rapport à leurs homologues adultes, mais étaient inchangés chez les hommes. Ces différences ne se sont pas directement traduites par des changements dans la force synaptique globale estimée à partir du rapport AMPA/NMDA, qui était plus faible chez les adolescentes. Enfin, les cours de développement de la potentialisation et de la dépression à long terme (LTP, LTD) étaient sexuellement dimorphiques. La LTP était présente de manière similaire pendant l’adolescence chez les mâles et les femelles mais n’était pas apparente à l’âge adulte chez les femelles. En revanche, la LTD a suivi un développement opposé : présente chez les femelles adolescentes et exprimée chez les deux sexes à l’âge adulte. Ces données révèlent des trajectoires maturatives divergentes dans la BLA des rats mâles et femelles et suggèrent des substrats cellulaires de la BLA liés à des comportements sexospécifiques à l’adolescence et à l’âge adulte.
Caractérisation des nutriosomes chargés de marc de raisin Nasco et leurs effets neuroprotecteurs dans le modèle de souris MPTP de la maladie de Parkinson.

Parekh, Serra, Allaw, Perra, Marongiu, Tolle, Pinna, Casu, Manconi, Caboni, Manzoni & Morelli
Les marcs de raisin ont récemment fait l’objet d’une grande attention pour leur richesse en polyphénols, des composés connus pour exercer des effets anti-inflammatoires et antioxydants. Ces marcs, cependant, ont une faible biodisponibilité cérébrale lorsqu’ils sont administrés par voie orale en raison de leur dégradation importante dans le tractus gastro-intestinal. Pour surmonter ce problème, l’extrait de marc Nasco a été incorporé dans un nouveau système de nanovésicules appelé nutriosomes, composé de phospholipides (S75) et de maltodextrine hydrosoluble (Nutriose® FM06). Les nutriosomes étaient petits, dispersés de manière homogène, avaient un potentiel zêta négatif et étaient biocompatibles avec les cellules épithéliales intestinales (Caco-2). L’extrait de marc de nasco s’est révélé riche en polyphénols antioxydants (acide gallique, catéchine, épicatéchine, procyanidine B2 et quercétine). Pour étudier l’effet neuroprotecteur du marc Nasco dans le modèle subaigu de la maladie de Parkinson (MPTP) chez la souris 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine, les nutriosomes Nasco ou la suspension Nasco ont été administrés par voie intragastrique et leurs effets neuroprotecteurs ont été évalués. La dégénérescence des neurones dopaminergiques nigro-striataux induite par un traitement subaigu au MPTP, la marque pathologique de la MP, a été évaluée par une analyse immunohistochimique de la tyrosine hydroxylase (TH) dans le caudé-putamen (CPu) et la substantia nigra pars compacta (SNc), et du transporteur de dopamine (DAT) dans le CPu. L’analyse immunohistochimique a révélé que les nutriosomes Nasco ont empêché de manière significative la réduction des fibres positives pour la TH et le DAT dans le CPu, et le nombre de cellules positives pour la TH dans le SNc après un traitement subaigu au MPTP, tandis que la suspension Nasco a neutralisé la toxicité du MPTP exclusivement dans le SNc. Dans l’ensemble, ces résultats mettent en évidence les effets thérapeutiques de l’extrait de marc de Nasco lorsqu’il est administré dans une formulation de nutriosome dans le modèle de souris MPTP subaigu de la maladie de Parkinson et valident l’efficacité de la préparation de nutriosome par rapport à la suspension comme un système innovant d’administration de nanomédicaments pour l’administration in vivo.
Cannabidiol et addiction : Rêve ou réalité
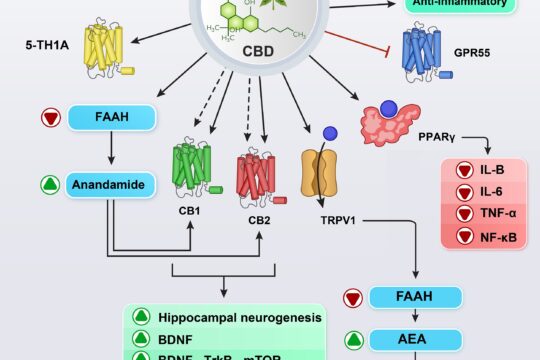
Karimi-Haghighiab, Razavi, Iezzi, Scheyer, Manzoni, Haghparast
Le cannabidiol (CBD) est l’un des principaux constituants du Cannabis sativa L. . Il est dépourvu de propriétés psychotomimétiques et il inhibe les effets gratifiants et renforçants des drogues addictives telles que la cocaïne, la méthamphétamine (METH) et la morphine. En outre, le profil d’innocuité et le potentiel thérapeutique du CBD sont actuellement évalués dans plusieurs conditions médicales, notamment la douleur, la dépression, les troubles du mouvement, l’épilepsie, la sclérose en plaques, la maladie d’Alzheimer, l’ischémie et les troubles liés à la consommation de substances. Il n’existe pas de traitement efficace pour les troubles liés à l’utilisation de substances, comme la dépendance, et cette revue vise à décrire les études précliniques et cliniques sur les effets du CBD dans divers modèles d’abus d’opioïdes, de psychostimulants, de cannabis, d’alcool et de nicotine. En outre, les mécanismes possibles qui sous-tendent le potentiel thérapeutique du CBD sur les troubles de la toxicomanie sont examinés.
L'exposition au cannabis par le lait maternel a des effets comportementaux et synaptiques à long-terme

Perinatal THC Exposure via Lactation Induces Lasting Alterations to Social Behavior and Prefrontal Cortex Function in Rats at Adulthood
Le cannabis est la drogue illicite la plus consommée au monde et la consommation chez les femmes pendant et autour de la période de grossesse augmente. Nous avons précedemment montré que l’exposition aux cannabinoïdes via la lactation au début de la période postnatale perturbe les trajectoires développementales de la maturation du cortex préfrontal et induit des anomalies de comportement au cours des premières semaines de vie chez les descendants de rats mâles et femelles. Dans cette nouvelle étude, nous avons analysé les conséquences au long terme de cette exposition postnatale aux cannabinoïdes sur les paramètres synaptiques et comportementaux chez la progéniture adulte des mères traitées au ∆9-tétrahydrocannabinol (THC). À l’âge adulte, ces rats exposés au THC pendant la période périnatale présentent des déficits de discrimination sociale accompagnés d’une augmentation globale du comportement d’exploration sociale. Ces altérations comportementales étaient en outre corrélées à de multiples anomalies de la plasticité synaptique dans le cortex préfrontal, notamment une perte de dépression à long terme (LTD) induite par les endocannabinoïdes, une perte de potentialisation à long terme et une augmentation du mGlu2 / 3-LTD. Enfin, les paramètres de base de l’excitabilité intrinsèque des neurones pyramidaux du cortex préfrontal ont été modifiés de manière similaire par l’exposition périnatale au THC. Ainsi, l’exposition périnatale au THC via la lactation induit des déficits durables de comportement et de fonction synaptique qui persistent jusqu’à l’âge adulte chez les descendants mâles et femelles.
La plasticité synaptique endocannabinoide dans les neurones D1 du noyau accumbens contrôle la recherche de récompense
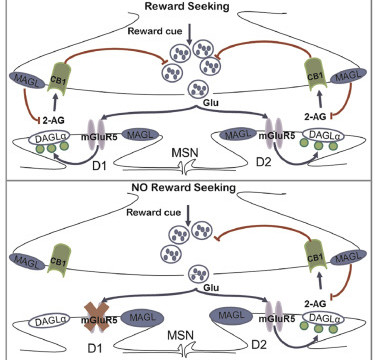
iScience https://doi.org/10.1016/j.isci.2020.100951
Le noyau accumbens (NAc) joue un rôle clé dans le comportement lié aux drogues et dans l’apprentissage naturel de la récompense. La plasticité synaptique des neurones à épines moyennes (MSN) du NAc, qui contiennent des récepteurs de dopamine D1 et D2, et le système des cannabinoïdes endogènes (eCB) ont été impliqués dans la recherche de la récompense. Cependant, la base moléculaire et physiologique précise du comportement de recherche de récompense reste inconnue. Nous avons découvert que la délétion spécifique du récepteur 5 du glutamate métabotropique (mGluR5) dans les MSN exprimant D1 (souris D1miRmGluR5) abolit la dépression à long terme (LTD) médiée par les eCB et empêche l’expression du comportement de recherche de drogue (cocaïne et éthanol), de récompense naturelle (saccharine) et de stimulation cérébrale. Le renforcement in vivo de la signalisation de l’eCB par le 2-arachidonoylglycérol (2-AG) dans le noyau du NAc restaure à la fois la dépression à long terme (LTD) et le comportement de recherche de récompense chez les souris D1miRmGluR5. Ces données suggèrent un modèle dans lequel les systèmes eCB et glutamatergiques de la NAc agissent de concert pour médier les réponses de recherche de récompense.
Contrôle de la connectivité fonctionelle de synapses désambiguisées du noyau accumbens par les endocannabinoïdes
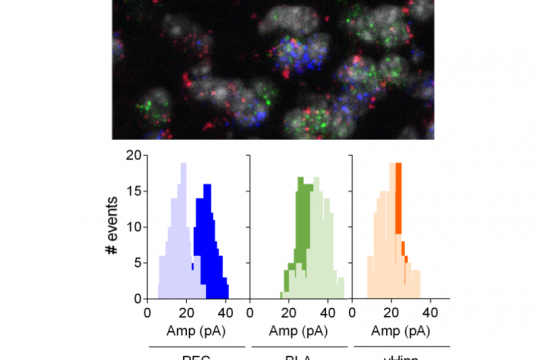
The Journal of Neuroscience 2019
Article disponible ici
Le noyau accumbens (NAc) est une structure mésocorticolimbique qui intègre les fonctions cognitives, émotionnelles et motrices. Son rôle dans les troubles psychiatriques est largement reconnu, mais la compréhension de ses circuits n’est pas complète. Ici, nous avons combiné des enregistrements optogénétiques et électrophysiologiques pour dresser un portrait fonctionnel des synapses excitatrices désambiguisées entre les neurones épineux moyens (MSN) D1 et D2 dans le noyau NAc de souris mâle adulte. La comparaison des propriétés synaptiques des projections de l’hippocampe ventral (vHipp), de l’amygdale basolatérale (BLA) et du cortex préfrontal (PFC) a révélé une hiérarchie des entrées synaptiques qui dépend de l’identité du MSN cible postsynaptique. Ainsi, le BLA est la voie d’excitation dominante sur les MSN D1 (BLA> PFC = vHipp) tandis que les projections PFC dominent les MSN D2 (PFC> vHipp> BLA). Nous avons également testé l’hypothèse selon laquelle les endocannabinoïdes confèrent aux circuits excitateurs une plasticité spécifique à l’échelle synaptique. Ainsi, alors que les récepteurs CB1 (CB1R) dépriment uniformément les voies d’excitation indépendamment de l’identité des MSN, les récepteurs TRPV1 (TRPV1R) contrôlent de manière bidirectionnelle les projections sur le NAc d’une manière synapse spécifique. Enfin, nous montrons que l’interaction de TRPV1R / CB1R façonne la plasticité au niveau des synapses BLA-NAc. Ensemble, ces données apportent un nouvel éclairage sur la les propriétes des circuit du NAc adulte et le rôle des endocannabinoïdes dans plasticité spécifique à l’échelle synaptique
Un projet de développement et collaboration international financé par la communauté européenne

New Business opportunities & Environmental suSTainability using MED GRAPE nanotechnological products
Le raisin, en tant que culture traditionnelle de la région méditerranéenne, a un fort potentiel d’innovation qui n’a pas encore été exploité de manière efficace. Les personnes travaillant dans le secteur de la culture du raisin sont généralement concentrées sur l’amélioration de la qualité du raisin et du vin, mais n’envisagent généralement pas de tirer le meilleur parti des déchets de raisin. Sur la base de l’expérience de recherche et développement des partenaires dans les domaines de la valorisation du raisin, de l’exploitation des déchets et du développement de formulations nanotechnologiques antioxydantes / anti-inflammatoires / anti-neurodégénératives, BESTMEDGRAPE vise à soutenir la création de nouvelles startups / PME en transférant des connaissances scientifiques / technologiques sur: les cultivars de raisin locaux et l’exploitation des sous-produits du vin en tant que source de composés bioactifs pouvant être transformés en produits de santé commerciaux innovants. Ainsi, le projet valorisera non seulement un produit méditerranéen – le raisin – mais aussi l’élargissement de la chaîne de valeur du raisin grâce au développement de produits nanotechnologiques, stimulant ainsi l’économie locale, réduisant la pollution de l’environnement et augmentant les possibilités d’emploi. http://www.enicbcmed.eu/fr/node/525
Cannabis et développement cérébrale

Journal of Neuroscience 2019
Series: Early-Life Stress and the Brain Review Article disponible ici
Conséquences de l'exposition périnatale au cannabis

Trends Neurosci. 2019
Biological Psychiatry Cannabis usage is increasing with its widespread legalization. Cannabis use by mothers during lactation transfers active cannabinoids to the developing offspring during this critical period and alters postnatal neurodevelopment. A key neurodevelopmental landmark is the excitatory to inhibitory GABA switch caused by reciprocal changes in expression ratios of the K+/Cl- transporters KCC2 and NKCC1.Treating rat dams with cannabinoids during early lactation retards transcriptional upregulation and expression of KCC2, thereby delaying the GABA switch in pups of both sexes. This perturbed trajectory was corrected by the NKCC1 antagonist bumetanide and accompanied by alterations in ultrasonic vocalization without changes in homing behavior. Neurobehavioral deficits were prevented by CB1R antagonism during maternal exposure, showing that CB1R underlie the cannabinoid-induced alterations. These results reveal how perinatal cannabinoid exposure retards an early milestone of development, delaying the trajectory of GABA’s polarity transition and altering early-life communication.
L'exposition au cannabis par le lait maternel perturbe la programmation périnatale

Cannabinoid exposure via lactation in rats disrupts perinatal programming of the GABA trajectory and select early-life behaviors
Biological Psychiatry Cannabis usage is increasing with its widespread legalization. Cannabis use by mothers during lactation transfers active cannabinoids to the developing offspring during this critical period and alters postnatal neurodevelopment. A key neurodevelopmental landmark is the excitatory to inhibitory GABA switch caused by reciprocal changes in expression ratios of the K+/Cl- transporters KCC2 and NKCC1.Treating rat dams with cannabinoids during early lactation retards transcriptional upregulation and expression of KCC2, thereby delaying the GABA switch in pups of both sexes. This perturbed trajectory was corrected by the NKCC1 antagonist bumetanide and accompanied by alterations in ultrasonic vocalization without changes in homing behavior. Neurobehavioral deficits were prevented by CB1R antagonism during maternal exposure, showing that CB1R underlie the cannabinoid-induced alterations. These results reveal how perinatal cannabinoid exposure retards an early milestone of development, delaying the trajectory of GABA’s polarity transition and altering early-life communication.

Publication dans Molecular Psychiatry: Haro sur le Gras!
Notre objectif général est de comprendre comment les microcircuits méso-corticolimbiques (MCL) sont formés au cours des premières périodes critiques de la vie, en particulier l’adolescence, pour donner lieu à des comportements émotionnels harmonieux et des fonctions cognitives adaptées à l’âge adulte. Plus précisément, nous voulons comprendre comment les insultes environnementales et génétiques modélisant les maladies neuropsychiatriques transforment l’architecture et la fonctionnalité des réseaux synaptiques et réduisent la plage de fonctionnement comportementale. Nos travaux précédents ont alimenté le concept selon lequel les dommages structurels et fonctionnels durant les premières années de la vie, y compris l’adolescence, sont causaux dans les déficits comportementaux liés à la maladie. Notre hypothèse de base est que l’adolescence délimite une période de vulnérabilité maximale et est donc un déterminant critique de la façon dont l’environnement et les gènes façonnent les fonctions des réseaux neuronaux à l’âge adulte (Bara et al. 2018; Manduca et al. 2017; Labouesse et. al. 2017; Bouamrane et al. 2017; Iafrati et al. 2016; Iafrati et al. 2014)). Notre projet de recherche permettra de réduite les phénotypes complexes en de nouveaux endophénotypes développementaux et de concevoir des stratégies thérapeutiques innovantes. Notre projet est organisé en trois objectifs: D’abord, nous vérifions systématiquement les propriétés structurelles et fonctionnelles afin de déterminer comment le développement façonne les microcircuits du MCL. Deuxièmement, nous utilisons une stratégie que nous avons récemment conçue, basée sur l’analyse multivariée des ensembles de données bootstrap (Iafrati et al., 2016) pour considérer la nature multidimensionnelle des données et évaluer l’interrelation entre les paramètres structurels, fonctionnels et comportementaux. Troisièmement, nous utilisons la stimulation optogénétique et la modulation pharmacologique de microcircuits neuronaux spécifiques pour recréer / compenser / réactiver un comportement adapté chez les rongeurs. Notre approche multidisciplinaire combine, électrophysiologie, ablation par cellule ciblée des récepteurs de toxines ciblant une population neuronale sélectionnée, imagerie in vitro et in vivo du calcium, neuroanatomie tridimensionnelle quantitative, optogénétique et analyse des comportements naturalistes dans les domaines émotionnel et cognitif.

Projet de Recherches
Notre objectif général est de comprendre comment les microcircuits méso-corticolimbiques (MCL) sont formés au cours des premières périodes critiques de la vie, en particulier l’adolescence, pour donner lieu à des comportements émotionnels harmonieux et des fonctions cognitives adaptées à l’âge adulte. Plus précisément, nous voulons comprendre comment les insultes environnementales et génétiques modélisant les maladies neuropsychiatriques transforment l’architecture et la fonctionnalité des réseaux synaptiques et réduisent la plage de fonctionnement comportementale. Nos travaux précédents ont alimenté le concept selon lequel les dommages structurels et fonctionnels durant les premières années de la vie, y compris l’adolescence, sont causaux dans les déficits comportementaux liés à la maladie. Notre hypothèse de base est que l’adolescence délimite une période de vulnérabilité maximale et est donc un déterminant critique de la façon dont l’environnement et les gènes façonnent les fonctions des réseaux neuronaux à l’âge adulte (Bara et al. 2018; Manduca et al. 2017; Labouesse et. al. 2017; Bouamrane et al. 2017; Iafrati et al. 2016; Iafrati et al. 2014)). Notre projet de recherche permettra de réduite les phénotypes complexes en de nouveaux endophénotypes développementaux et de concevoir des stratégies thérapeutiques innovantes. Notre projet est organisé en trois objectifs: D’abord, nous vérifions systématiquement les propriétés structurelles et fonctionnelles afin de déterminer comment le développement façonne les microcircuits du MCL. Deuxièmement, nous utilisons une stratégie que nous avons récemment conçue, basée sur l’analyse multivariée des ensembles de données bootstrap (Iafrati et al., 2016) pour considérer la nature multidimensionnelle des données et évaluer l’interrelation entre les paramètres structurels, fonctionnels et comportementaux. Troisièmement, nous utilisons la stimulation optogénétique et la modulation pharmacologique de microcircuits neuronaux spécifiques pour recréer / compenser / réactiver un comportement adapté chez les rongeurs. Notre approche multidisciplinaire combine, électrophysiologie, ablation par cellule ciblée des récepteurs de toxines ciblant une population neuronale sélectionnée, imagerie in vitro et in vivo du calcium, neuroanatomie tridimensionnelle quantitative, optogénétique et analyse des comportements naturalistes dans les domaines émotionnel et cognitif.
Collaborateurs
Nationaux – Barbara Bardoni (Autism / CNRS UMR 7275, IPMC, Nice). – Sophie Layé (Nutrition & Integrative Neurobiology / INRA UMR 1286, Bordeaux). Internationaux -Miriam Melis (University of Cagliari, Italie) -Urs Meyer (Université de Zürich Suisse) – Ken Mackie (Gill Center for molecular neuroscience, University of Indiana, Bloomington) – Rainer Spanagel (CB1R and mGluRs in the mesolimbic pathway / Mainz University, Germany).














