Axes de recherche
- aLes patrons physiologiques d'activité dans le cerveau en développement
- bOrganisation des réseaux neuronaux du cortex somatosensoriel primaire en développement
- cLes changements développementaux dans la signalisation GABA
- dRôle des protéines à déformation membranaire dans le développement cortical
- eCerveau sain et pathologique & exercice
- fTraumatismes crâniens et plasticité post-lésionnelle
Les patrons physiologiques d'activité dans le cerveau en développement
Rustem Khazipov & Marat MINLEBAEV
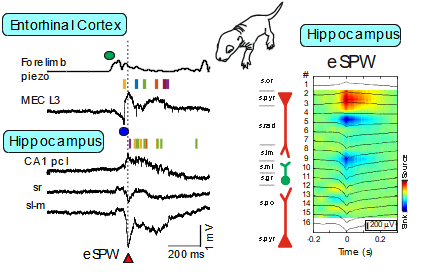
Les premières recherches sur les schémas d’activité des réseaux neuronaux en développement s’appuyaient sur des préparations ex vivo de rongeurs nouveau-nés. Ces études ont mis en évidence des bouffées d’activité spontanée au sein des réseaux neuronaux — telles que les potentiels géants dépolarisants (GDPs) hippocampiques et les premières oscillations — et ont permis d’en identifier les mécanismes sous-jacents (Ben-Ari et al., 2007 ; Khalilov et al., 2015 ; Leinekugel et al., 1997). Cependant, la pertinence physiologique de ces patrons pour l’activité cérébrale néonatale in vivo restait incertaine. Nous avons donc développé une plateforme combinant enregistrements intracorticaux multisites par sondes silicon et techniques de patch-clamp chez le raton. Cette approche pionnière nous a permis de caractériser in vivo les « early sharp waves » (eSPWs) dans l’hippocampe (Leinekugel et al., 2002). Ces eSPWs sont déclenchées par des mouvements spontanés et impliquent l’activation du cortex entorhinal (Valeeva et al., 2019). Nous avons également identifié des oscillations liées aux mouvements dans le cortex somatosensoriel primaire (S1) et le thalamus (Akhmetshina et al., 2016 ; Khazipov et al., 2004 ; Minlebaev et al., 2011), ainsi que dans la moelle épinière (Inacio et al., 2016). De même, nous avons observé des bouffées dans le cortex visuel primaire déclenchées par les vagues rétiniennes (Colonnese et al., 2010 ; Colonnese & Khazipov, 2010 ; Hanganu et al., 2006). L’imagerie biphoton a elle permis de révéler une activité synchrone encore plus précoce, dans le cortex embryonnaire de la souris (Yuryev et al., 2018). La portée translationnelle de ces travaux est démontrée dans le cadre d’une collaboration de longue date avec l’équipe d’Anna Kaminska à l’Hôpital Necker (Paris), où nous avons contribué à l’élaboration de protocoles d’exploration sensorielle chez le nouveau-né, couvrant différentes modalités (Chipaux et al., 2013 ; Colonnese et al., 2010 ; Kaminska et al., 2018 ; Milh et al., 2007).
Organisation des réseaux neuronaux du cortex somatosensoriel primaire en développement
Ingrid Bureau & Juliette Contadini
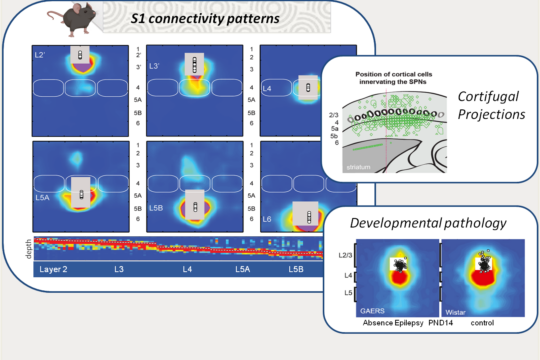
Le cortex somatosensoriel primaire (S1) est structuré en couches et en colonnes, innervées de manière différenciée par les neurones locaux et par les structures de l’intégration tactile. Son architecture composée de voies dites de premier et de second niveau, joue un rôle fondamental dans l’intégration sensorielle ainsi que dans la genèse des réponses motrices, notamment via ses projections vers des structures du contrôle moteur, comme le striatum. En nous appuyant sur des approches de cartographie fonctionnelle (ex, la photostimulation par balayage laser couplé au patch-clamp), nous étudions la formation de ces réseaux chez le rongeur ainsi que leur plasticité en lien avec les apprentissages ou leurs altérations dans des modèles pathologiques. Récemment, nous avons montré des motifs d’innervation transitoires au cours du développement sain mais absents dans un modèle d’épilepsie d’absence suggérant leur importance dans l’épileptogenèse et/ou les comorbidités (lien). Par ailleurs, nous avons identifié un motif spécifique d’innervation des neurones striataux par les sorties corticales, qui permet de résoudre un paradoxe de longue date : la coexistence d’une innervation corticostriatale diffuse avec une sélectivité sensorielle marquée des neurones striataux (lien).
Les changements développementaux dans la signalisation GABA
Rustem Khazipov & Ilgam Khalilov
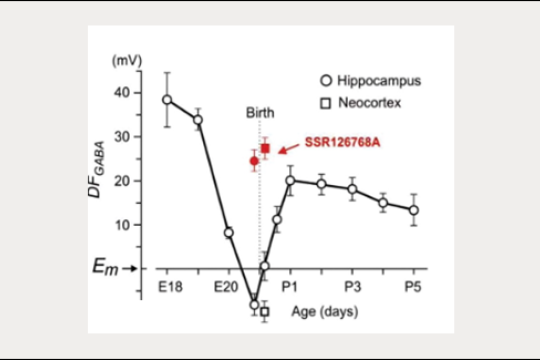
Nos études précédentes ont identifié des rôles pour les actions dépolarisantes et excitatrices exercées par le GABA sur les neurones immatures, et des actions synergiques du GABA et du glutamate dans la génération de GDPs in vitro (Ben-Ari et al., 2007 ; Khalilov et al., 2015 ; Leinekugel et al., 1997). Divers aspects des actions dépolarisantes du GABA sur les neurones immatures ont été caractérisés: le changement périnatal médié par l’ocytocine dans le switch inhibiteur du GABA, le dualisme et les changements dynamiques dépendants de l’activité GABA au niveau des réseaux (Khalilov et al., 1999 ; Khalilov et al., 2017 ; Tyzio et al., 2006 ; Valeeva et al., 2010). Ces résultats ont été principalement obtenus in vitro sur de tranches ou des préparations de cerveau intact. Or, les explorations in vivo ont donné des résultats différents, compatibles avec l’action plutôt inhibitrice qu’excitatrice du GABA chez le rongeur néonatal (Colonnese et al., 2010 ; Minlebaev et al., 2007 ; Valeeva et al., 2016). Il est intéressant de noter que l’action dépolarisante du GABA semble être un facteur de divers modèles pathologiques, comme l’épilepsie (Dubanet et al., 2021b ; Khalilov et al., 2003 ; Kourdougli et al., 2017 ; Nardou et al., 2009 ; Pallud et al., 2014) et les traumatismes cérébraux (Dzhala et al., 2012 ; Goubert et al., 2019). Ces changements dans l’action du GABA ont été associés à une baisse de l’extrusion de chlore médiée par KCC2, et ont pu être partiellement corrigés avec un bloqueur sélectif du cotransporteur NKCC1, le bumétanide. Néanmoins, en ce qui concerne le développement, la pertinence du GABA excitateur dans ces conditions pathologiques in vivo fait toujours débat , et n’a pas été confirmée par la seule étude directe réalisée in vivo utilisant la méthodologie développée par notre groupe (Dubanet et al., 2021b).
Rôle des protéines à déformation membranaire dans le développement cortical
Claudio Rivera & Aurélie Carabalona
Le développement du cortex cérébral est un processus extrêmement complexe qui se divise en trois étapes : la prolifération des progéniteurs neuronaux, la migration neuronale, puis la maturation des réseaux de neurones. Ces différentes étapes nécessitent un remodelage important des membranes et une dynamique du cytosquelette. On sait peu de choses sur les mécanismes moléculaires qui sous-tendent la dynamique membranaire pendant la migration neuronale et la morphogenèse.
La courbure de la membrane cellulaire est un changement micro-morphologique impliqué dans de nombreux processus cellulaires importants, notamment l’endocytose, l’exocytose et la migration. Des études récentes ont démontré que les membres d’une famille de protéines, caractérisée par la présence d’un domaine BAR (Bin- Amphiphysin-Rvs) permettant la liaison et la déformation membranaire, fonctionnent à l’interface entre le cytosquelette d’actine et la membrane plasmique lors de la formation de protrusions ou invaginations de la membrane (Doherty et McMahon, 2008 ; Frost et al, 2009 ; Takano et al, 2008). Ces protéines peuvent soit générer une courbure positive de la membrane pour faciliter la formation d’invaginations de la membrane plasmique (les protéines N-BAR et F-BAR), soit induire une courbure négative de la membrane pour favoriser la formation de protrusions de la membrane plasmique (les protéines I-BAR et IF-BAR) (Guerrier et al., 2009 ; Mattila et al., 2007). Ces protéines peuvent interagir avec les membranes riches en phosphatidylinositol-4,5-biphosphate (PI(4,5)P2) grâce à leur domaine BAR et aussi avec le cytosquelette d’actine grâce au domaine Wasp Homology-2 (WH2). La régulation du cytosquelette d’actine est bien décrite dans les neurones : migration neuronale, extension et guidage axonal et dendritique, formation des épines dendritiques (Spillane et al., 2011). Nous avons récemment découvert que Mim, membre de la famille des protéines I-BAR, joue un rôle fondamental dans la formation des filopodes neuronaux, et dans la morphologie des épines (Saarikangas et al., 2015). Cependant, la régulation du cytosquelette d’actine dans les cellules gliales est très peu étudiée, et un seul régulateur spécifique, la protéine I-BAR nommée Abba, a été décrite jusqu’ici (Saarikangas et al., 2008). Pendant le développement cortical, Abba est fortement exprimée dans les cellules progénitrices de la glie radiaire. Malgré le rôle potentiel d’Abba dans le développement neuronal, on en sait très peu sur cette protéine, y compris sur le fait qu’elle peut entraîner une pathologie neurologique (Alazami et al., 2015).
Ce projet vise à caractériser phénotypiquement et mécaniquement un nouveau syndrome de malformation cérébrale lié à des mutations du gène ABBA, nos objectifs sont de :
1) déterminer le rôle d’Abba dans les cellules progénitrices de la glie radiaire
2) explorer les partenaires potentiels d’Abba afin de définir le mécanisme moléculaire dans le(s)quel(s) elle est impliquée et l’impact sur le développement cortical.
3) corréler nos résultats avec la pathologie humaine grâce à nos différentes collaborations avec les cliniciens.
Les mécanismes contrôlant les changements dynamiques de la morphologie de la cellule commencent à être décortiqués. Ce domaine de recherche et en plein essor et et aura un impact profond sur la façon dont nous comprenons le développement du cortex cérébral.
Cerveau sain et pathologique & exercice
Jérôme Laurin, Claudio Rivera & Christophe Pellegrino
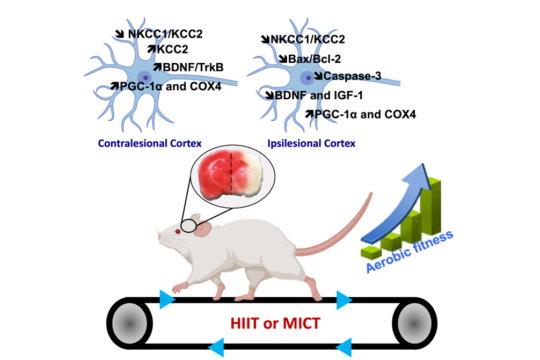
Cette thématique de recherche porte sur l’impact des différents exercices physiques d’endurance sur les fonctions corticales et hippocampiques et les fonctions cognitives et sensorimotrices chez le sujet sain (jeune et âgé) ou atteint d’accident vasculaire cérébral (AVC). Nous abordons ce sujet en utilisant des mesures pluridisciplinaires pour les différents modèles d’étude : comportementales (sensorimotrices, cognitives, état dépressif), moléculaires pour définir les signatures moléculaires de chaque méthode d’entraînement et électrophysiologiques pour voir une approche plus fonctionnelles). A partir de ces différentes mesures, nous cherchons à définir le rôle des acteurs moléculaires majeurs de la plasticité cérébrale en nous focalisant sur les facteurs neurotrophiques, leur interaction avec les co-transporteurs des ions chlorures et la neurogenèse. Le lactate et des myokines font partie de ces acteurs de la plasticité cérébrale à partir desquels nous cherchons à trouver les mécanismes propres à chaque méthode d’entraînement pour justifier leur intérêt précis.
Traumatismes crâniens et plasticité post-lésionnelle
Christophe Pellegrino & Marine Tessier
Les traumatismes crâniens (TC) sont la principale cause de décès et d’invalidité permanente liés aux blessures. En France, l’accident vasculaire cérébral (AVC) et l’insulte traumatique sont la 3ème cause de mortalité après les cancers et les maladies cardio-vasculaires. 20% des patients souffrant de TC meurent dans le mois qui suit la blessure. 75 % des survivants d’AVC ou de TC souffrent de l’accident toute leur vie et de façon plus dramatique jusqu’à 25 % ne reviendront jamais à la vie professionnelle.
La neurodégénérescence, telle qu’observée dans les TC, est une suite dévastatrice commune à de nombreux troubles neuropathologiques. La neurodégénérescence induite par les TC est également un facteur de risque majeur d’épilepsie et de troubles dépressifs majeurs, mais les mécanismes de la dépression post-traumatique sont mal compris. L’opinion actuelle est que le cerveau réagit aux insultes pathologiques en activant des programmes de type développemental pour la survie, la régénération et le remplacement des neurones endommagés. Par exemple, nous avons montré que ce n’est qu’après une lésion que les neurones centraux matures deviennent dépendants du soutien trophique du facteur neurotrophique dérivé du cerveau (BDNF) pour survivre. Il est intéressant de noter que la neurogenèse secondaire qui se produit dans l’hippocampe est un acteur clé dans l’établissement de la dépression post-traumatique. Nos objectifs sont :
I) D’étudier les mécanismes de la neurogenèse secondaire après un traumatisme ;
II) D’analyser les réseaux neuronaux et plus précisément la neurotransmission GABA en condition pathologique ;
III) D’étudier les processus inflammatoires à la base de la mort neuronale ;
IV) D’étudier les conséquences fonctionnelles de telles insultes du gène au comportement.
Cependant, les mécanismes intrinsèques à l’origine des changements induits par les traumatismes dans la transmission de GABAA et le réarrangement du réseau post-traumatique qui en résulte ne sont pas connus. Nous voulons comprendre comment les processus de neuro-inflammation pourraient participer à l’établissement des conséquences à long terme des traumatismes crâniens par des changements dans la neurogenèse secondaire et l’intégration synaptique.
Il est important de comprendre que la réorganisation progressive et retardée des réseaux neuronaux peut accentuer les séquelles tardives couramment observées chez les patients souffrant de différentes formes de lésions cérébrales, par exemple la dépression post-traumatique.
Notre équipe est bien connue pour ses réalisations dans la recherche en pleine expansion sur la régulation des ions neuronaux et son rôle dans la signalisation, le développement, la plasticité et la pathophysiologie (Pallud et al., 2014 ; Pellegrino et al., 2011 ; Payne et al., 2003 ; Blaesse et al., 2009 ; Rivera et al., 2005). En combinant la biologie moléculaire et l’électrophysiologie, nous avons découvert que le co-transporteur neuronal du K-Cl, le KCC2, joue un rôle clé dans le passage de la neurotransmission à médiation GABAA de la dépolarisation à l’hyperpolarisation (Rivera et al., 1999), et montré que la régulation dépendante de l’activité de l’expression du KCC2 nécessite une signalisation BDNF (Rivera et al., 2002). Les travaux en cours ont révélé le rôle central des CCSC dans la plasticité neuronale et les mécanismes de la maladie, en particulier l’épilepsie et le traumatisme (Pallud et al., 2014 ; Huberfeld et al., 2007). Les travaux sur les mécanismes moléculaires sous-jacents à ces effets ont permis d’identifier un nombre croissant d’interactions nouvelles et fondamentales entre les facteurs de croissance et les CCC (de Koninck Y et al., 2007 ; Viemari et al., 2011).
Approches expérimentales
Nous utilisons une combinaison d’électrophysiologie et d’imagerie (signalisation optique intrinsèque, imagerie tensio-sensible) pour étudier l’activité cérébrale en situation in vivo ainsi que sur tranches aigues in vitro mais aussi des approches au niveau cellulaires et moléculaires.
Mots clés
Nouveau-né, électroencéphalogramme, cortex somato-sensoriel, GABA, hypoxie, développement, ocytocine, traumatisme cérébral, cortex cérébral
Collaborations
Prof G. Buzsaki (Rutgers, Etats-Unis) sur l’activité du cerveau et du traitement sensoriel chez les rats nouveau-nés ;
Prof GL Holmes (Harvard-Dartmouth, Etats-Unis) sur l’activité paroxystique dans le cerveau en développement et les conséquences des convulsions néonatales ;
Le Dr Anna Kaminska et C.Chiron (Saint-Vincent de Paul, Paris) sur l’ontogenèse de l’EEG humain ;
Prof O.Delalande (Rotschild Fondation, Paris) sur les propriétés neuronales et le réseau du cortex épileptique humain immature ;
M. Mazzuca (Necker) et le Prof R.Giniatullin (Université de Kuopio, Finlande) sur les actions analgésiques de l’ocytocine à la naissance ;
Drs. R.Nabout et C.Chiron (Necker, Paris) sur le modèle animal du syndrome de Dravet ;
Dr G. Huberfeld (Necker) épilepsie
Dr A. Sirota (Université de Tübingen, Allemagne) sur le traitement du signal ;
L’équipe est également impliquée dans un projet collaboaratif avec le laboratoire de l’Université de Kazan, en Russie, financé par la subvention du Gouvernement de la Fédération de Russie.
Anciens membres de l'équipe
Inacio Ana-Rita (post-doc)
Carreno Maria Isabel (PhD student)
Dubanet Olivier, PhD (PhD student)
Medrano Maria Carmen (post-doc)
Bony Guillaume (post-doc)
Leinekugel Thomas (Ingénieur)
Aurelie Carabalona (post-doc)
Coralie Discala (post-doc)
Laura Caccialupi (post-doc)
Amina Rezzag (PhD student)
Florence Molinari, CRCN INSERM
Marine Tessier (PhD student)
Amandine Consumi (PhD student)
Azat Gainutdinov (PhD student)
Milh M (PhD student)
Tyzio R. (postdoc)
Kourdougli N (PhD student)
Goubert E (PhD student)
Hanganu I (post doc)
Colonnese M (post doc)
Melyan Z (post doc)
Morozova E (student)
Lamsa K (post doc)
Congar P. (PhD student)
Dzhala V. (postdoc)
Petanjek Z (postdoc)
Kenza Amroune (PhD student)
stages, thèses, post docs
L’équipe accueille des étudiants niveau M1, M2, doctorat ou post-doctorat.
Candidatures à adresser par email à:
roustem.khazipov@inserm.fr
claudio.rivera@inserm.fr
christophe.pellegrino@inserm.fr
ingrid.bureau@inserm.fr